Kementerian Kesihatan Malaysia (KKM) ingin memaklumkan bahawa Pihak Berkuasa Kawalan Dadah (PBKD), KKM pada 20 Mac 2023 telah bersetuju untuk membatalkan pendaftaran dan mengeluarkan arahan panggil balik ke atas semua produk berdaftar yang mengandungi pholcodine.
Ini berikutan terdapatnya risiko keselamatan yang dikesan iaitu risiko terjadinya anafilaksis (reaksi alahan teruk yang boleh mengancam nyawa) dengan penggunaan ubat pengendur otot (muscle-relaxant) atau neuromuscular blocking agents (NMBAs) semasa proses pembiusan umum (general anaesthesia), terutamanya kepada mereka yang pemanah mengambil ubat yang mengandungi pholcodine dalam tempoh 12 bulan lalu.
Dengan erti kata lain, mereka yang mengambil ubat yang mengandungi pholcodine (kebiasaannya ubat batuk) dalam tempoh 12 bulan lalu berhadapan risiko yang lebih tinggi untuk mengalami anafilaksis sekiranya diberi ubat pengendur otot atau neuromuscular blocking agents (NMBAs) semasa proses pembiusan penuh (general anaesthesia), misalnya semasa menjalani pembedahan.
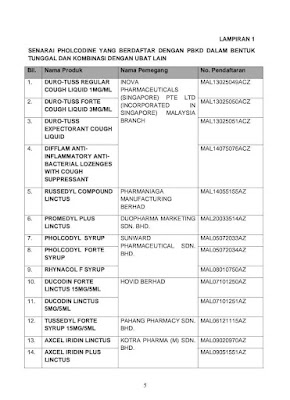
Pholcodine adalah sejenis ubat bagi mengawal dan menghentikan batuk jenis kering (nonproductive/dry, irritating) di dalam kalangan dewasa dan kanak-kanak. Di Malaysia, pholcodine diklasifikasikan sebagai ubat terkawal Kumpulan C dan boleh diperolehi tanpa preskripsi. Terdapat sejumlah 14 produk mengandungi pholcodine yang berdaftar dengan PBKD dalam bentuk tunggal dan kombinasi dengan ubat lain seperti dalam Lampiran 1.
Setakat ini, Pusat Pemonitoran Kesan Advers Ubat Kebangsaan, Bahagian Regulatori Farmasi Negara (NPRA) telah menerima sejumlah 12 laporan dengan 17 kesan advers susulan penggunaan pholcodine. Namun begitu, daripada laporan tersebut, tiada laporan anaphylaxis yang diterima.
Walaupun tiada laporan kesan advers diterima oleh NPRA setakat ini, keputusan PBKD ini diambil berdasarkan bukti-bukti daripada kajian “Allergy to Neuromuscular Blocking Agents and Pholcodine Exposure” (ALPHO), data keselamatan pasca pemasaran dan maklumat yang diperoleh daripada pengamal perubatan, agensi negara-negara lain seperti United Kingdom (UK), Australia, beberapa negara European Union (EU) seperti Perancis dan Norway di mana mereka telah mengambil tindakan regulatori bagi pembatalan dan panggil balik produk yang mengandungi pholcodine
berdasarkan maklumat keselamatan ini.
Selain itu, World Health Organization (WHO) juga turut melaporkan sejumlah 852 laporan kesan advers yang melibatkan penggunaan pholcodine. Daripada jumlah tersebut, terdapat 42 laporan anaphylactic reaction dan 20 laporan anaphylactic shock yang dilaporkan. Daripada kes tersebut, terdapat 9 kes yang melibatkan penggunaan bersama NMBA (suxamethonium).
Dengan itu, berdasarkan penilaian risiko yang teliti didapati tiada langkah pengurangan risiko yang dapat diambil bagi meminimumkan risiko ini buat pengguna. Justeru, didapati risiko pengambilan ubat pholcodine didapati telah melebihi manfaatnya. Sehubungan itu, PBKD telah bersetuju untuk membatalkan pendaftaran semua produk yang mengandungi pholcodine dan menjalankan prosedur panggil balik.
Sebagai makluman, terdapat ubatan alternatif yang boleh digunakan bagi indikasi batuk jenis kering (nonproductive/dry, irritating) seperti produk yang mengandungi dextromethorphan. Sehingga kini, terdapat lebih daripada 40 produk mengandungi dextromethorphan dalam bentuk tunggal dan kombinasi dengan ubat lain yang berdaftar dengan PBKD.
Susulan pembatalan pendaftaran produk mengandungi pholcodine, semua syarikat Pemegang Pendaftaran Produk bertanggungjawab untuk memaklumkan kepada farmasi komuniti dan klinik-linik yang telah dibekalkan dengan produk tersebut untuk berhenti menjual dan memastikan produk dikuarantin sebelum dipulangkan semula kepada pembekal.
Anggota kesihatan juga diingatkan untuk berhenti memperskripsi, mendispens, menjual atau mengedar semua produk mengandungi pholcodine dengan serta-merta. Pesakit yang mengalami batuk jenis nonproductive hendaklah diberikan ubat alternatif. Semua baki stok produk yang mengandungi pholcodine perlu dikuarantin dan dipulangkan semula
kepada pembekal.
NPRA juga telah mengeluarkan pemakluman Safety Alert bertajuk Pholcodine: Risk of Anaphylaxis to Neuromuscular Blocking Agents (NMBAs) bertarikh 9 Mac 2023 (kemaskini pada 23 Mac 2023) melalui laman sesawang rasmi NPRA bagi memastikan isu keselamatan dengan penggunaan pholcodine dapat diberi perhatian sewajarnya.
Orang awam yang sedang mengambil ubat batuk dan selsema diingatkan untuk menyemak label atau sisip bungkusan produk, sama ada terdapat bahan aktif pholcodine. Jika didapati ubatan tersebut mengandungi bahan aktif pholcodine, hentikan pengambilan dan rujuk kepada anggota kesihatan bagi mendapatkan rawatan alternatif. Bagi mereka yang perlu menjalani pembedahan dan memerlukan bius sepenuhnya, maklumkan kepada anggota kesihatan sekiranya anda pernah mengambil ubat yang
mengandungi pholcodine terutamanya dalam tempoh 12 bulan lalu.
Orang awam yang mempunyai sebarang pertanyaan dan memerlukan maklumat lanjut boleh merujuk kepada anggota kesihatan seperti doktor dan ahli farmasi. KKM menggalakkan orang awam untuk melaporkan sebarang kesan advers yang disyaki kepada pihak NPRA. Pelaporan kesan advers boleh dibuat secara atas talian dengan mengisi borang pelaporan untuk pengguna, iaitu Consumer Side Effect Reporting Form (ConSERF) yang boleh diakses di laman sesawang NPRA www.npra.gov.my .
Sekian, terima kasih.
TAN SRI DATO’ SERI DR. NOOR HISHAM ABDULLAH
KETUA PENGARAH KESIHATAN
23 MAC 2023












0 Ulasan